■JPT-online■
| ◆ 第3章 本邦の臨床試験の質に関する分析と考察 | ◇ 第1節 | 目的 |
| ◇ 第2節 | 本邦の臨床試験におけるGCP違反・逸脱 | |
| ◇ 第3節 | GCP査察結果の日米比較 | |
| ◇ 第4節 | 発見された違反・逸脱の重大さ | |
| ◇ 第5節 | 新GCPの実施と本邦における臨床試験の質の変化 | |
| ◇ 第6節 | 新GCP下で実施された試験のGCP調査結果 | |
| ◆ 文 献 | ||
| ◆ 表 | ||
 へ へ |
||
 へ へ |
||
第5節 新GCPの実施と本邦における臨床試験の質の変化
第4節まで,主として旧GCP下で実施された臨床試験の特徴を,欠点を具体的に挙げることにより説明した。 本節では,これらの特徴を有する日本の臨床試験が,新GCPの実施で今後どのように変わっていくのかを予想する。
臨床試験の「質」を定義するのは容易なことではない。質を構成する次元(側面)には,データの狭義の質が優れていること, 法律を遵守していること,経済学的効率の達成,公正・公平であること,道徳的であること等が挙げられる 4040)小野俊介. 治験の「質」の定義に関する考察. 臨床薬理 1998; 29(3): 591-2., 41)41)小野俊介. 治験現場からみたモニタリングおよび監査. 行政の立場から. 臨床医薬 1998; 14(14): 2510-2.。
新GCPの実施が,こうした多次元的な側面からなる臨床試験の質にどう影響するかは興味深い問題である。 しばしば,「新GCPの実施により日本の試験の質は高くなる」との漠然とした期待を耳にするが, そもそもこの期待を具体的に定義することは難しく,また,この期待が現実のものとなるかは自明とは言い難い。 より一般的な政策評価の言葉を用いるとすれば,問題は,新GCPという規制の強化が, それに伴い生じる費用の増加を上回る便益を生み出すかどうかと定義されるべきである。
費用と便益の経済学的な観点からの考察は次章で行うこととし,臨床試験の特徴に焦点を当てた本章においては, 本邦の臨床試験の質の二つの側面,すなわちデータの狭義の質と臨床試験に対する認識に対して新GCPが与える影響を考察する。
第1項 狭義のデータの質の変化
科学的データの質の定義に関しては,正確度accuracyと精度precisionの視点からの評価はさまざまな領域で行われており, 臨床試験のデータに関してもかかる視点は適用可能である。これらに加えて,臨床試験データについては, GCP適合性やデータマネージメントの適切性を踏まえたデータの信頼性reliabilityという概念もしばしば適用される。
前節までに示したGCP違反例の多くは,accuracyとprecisionの両方に悪影響を与えるが, どちらか一方への影響が「概念的に」大きいと考えられるものもある。 たとえば,被験者の登録基準違反は明らかにaccuracyに悪影響を与えるものであり, 併用薬違反もaccuracyへの影響が心配である。全般改善度評価における曖昧な評価基準については, 直接にはばらつきへの影響が懸念されるが,試験の金銭的なインセンティブがある場合には, そのようなインセンティブの存在により何らかの系統的なupward bias(効果が高く見える方向)が生じている可能性も否定できない。
わが国の臨床試験に蔓延していたCRF上のケアレスミスは,一般的に,precisionに悪影響を与える要因であると考えられる。 各症例の投薬・観察終了後数ヵ月も経過してから過去の記憶を頼りにCRFの全般改善度等を記入するといった過去の慣例は,precisionのみでなく, accuracyにも当然影響を与えうる。また,上述のupward biasが入り込む余地も高いと考えられる。
Fig. 3-1に狭義のデータの質に新GCPの導入が与える影響を概念的に示す 11)11)Ono S, Kodama Y. Clinical trials and new good clinical practice guideline in Japan.Pharmacoeconomics 2000;18:125-41.。 新GCPの実施は,accuracy,precision両方を改善するが,特にCRF等の文書の扱いに関する改善が予想どおりに起これば, precisionへの影響がより大きいと考える。Accuracyの改善には,新GCPの実施だけでなく, たとえば評価基準の明確化・客観化といった臨床試験の方法論自体の改善も同時に起こらなければならない 14)14)広津千尋.比較臨床試験解析:最近の話題から.臨床評価 1995;23:489-521.。
Fig. 3-1
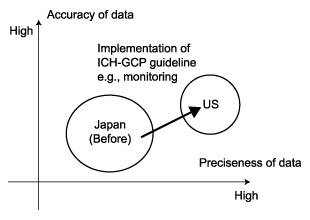
Schematic representation of the difference in scientific quality of clinical trials between Japan and US.
The arrow indicates the possible direction of changes in quality

第2項 臨床試験に対する認識における変化
次に,倫理的側面から見た本邦の臨床試験の特徴と新GCPの導入の影響をFig. 3-2に示す。
Fig. 3-2の横軸は「臨床試験を研究と認識しているかどうか」である。 試験を実施している医師は,もちろん,臨床試験が通常の治療とは異なる科学的動機に基づくものであることを(程度の差はあれ)認識しているが, 従来,被験者がそのような認識を十分に有していたかどうかについては疑問があった。 さらに自らが参加している臨床試験の方法論(たとえばランダム化,プラセボ使用の意義)の理解に至っては, アンケート調査で患者の50%が「理解していない」と回答している 42)42)中野重行. 日本の治験におけるインフォームド・コンセントの実態. 薬理と治療 1997; 25(9): 2223-47.。
Fig. 3-2の縦軸は「被験者(医師)が参加に伴うメリットを求めるかどうか」という視点である。 これは,試験に参加する被験者(場合によっては医師)の特性である。 日本の臨床試験は国民皆保険の医療制度の中で実施されているという背景もあり, 本邦では,一般にプラセボを使用する試験やリスクの高い試験が好まれない。 たとえば,先のアンケート調査では,回答した87%の被験者が試験に参加することにした理由として「薬が有効であること」を挙げ, また,92%の被験者が「副作用が少ないこと」が重要と答えている 42)42)中野重行. 日本の治験におけるインフォームド・コンセントの実態. 薬理と治療 1997; 25(9): 2223-47.。
この視点に関して,米国においては,加入する保険の制限から(あるいは保険自体に未加入であるため), 特に低所得層の患者にとっては臨床試験が唯一の治療の手段となっていることがしばしば報じられている 43)43)Kolata G, Eigenwald K. For the uninsured, experiments may provide the only treatment. New York Times 1999 Jun 22 [on line]。
さらに,臨床試験に関する広告が事実上禁じられていたことを背景として, 本邦において臨床試験に関係する情報が被験者に十分に伝わっていなかったことも事実である。 ここでの「情報」とは,個々の患者に対する情報と社会一般の啓蒙的情報の両方を意味する。 このような情報の欠如は,被験者に臨床試験を治療と誤解させる(Fig. 3-2の横軸で左側方向に位置させる)のみでなく, 被験者の態度をより保守的にし,直接の治療上の利益をより重視させる可能性がある(Fig. 3-2の縦軸で上方向に位置させる) 11)11)Ono S, Kodama Y. Clinical trials and new good clinical practice guideline in Japan.Pharmacoeconomics 2000;18:125-41.。
臨床試験であれ治療であれ,患者には利益が生じる「べき」であり,確実に不利益が生じるプラセボの使 用等を行う「べき」ではないとするスタンスをとる治験実施医師も存在する。 後述するように,世界医師会のエジンバラ改訂ヘルシンキ宣言(2000年)も,基本的にそのようなスタンスに立っており, そのような医師の存在は我が国に固有の話ではない44)44)Helsinki's New Clinical Rules: Fewer Placebos, More Disclosure. Science 2000; 290: 418-9.。 しかし,実際にプラセボ対照試験がどの程度実施されているかは,FDAと厚生労働省の承認審査上のスタンスの違いを反映してか, 日本と米国では大きな違いがある。これも本邦の位置付けをFig. 3-2の縦軸方向に向かわせる要因である。
新GCPの実施により,被験者は従来必ずしも十分に詳細には伝えられなかった試験の諸条件, たとえばランダム化により一定の確率でプラセボ群に割り付けられること等をはっきり認識することになり, Fig. 3-2の矢印のような横軸の動きが起こると予想される。 一方で,被験者(医師)が試験に直接に治療上の利益を求めなくなるかどうかは, 臨床試験の保険医療一般における位置付けが変わらない以上,新GCPの実施に伴ってそれほど大きな動きは起こらない可能性が高いと考える。
Fig. 3-2
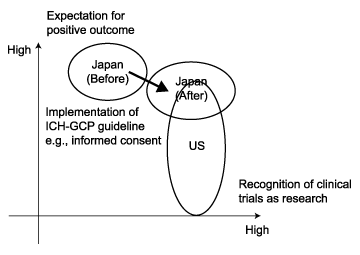
Schematic representation of the difference in ethical quality of clinical trials between Japan and US.
The arrow indicates the possible direction of changes in quality.
The arrow indicates the possible direction of changes in quality.