■JPT-online■
| ◆ 第4章 本邦の臨床試験の質に関する分析と考察 | ◇ 第1節 | 臨床試験の実施に伴う費用と便益 |
| ◇ 第2節 | 新GCP導入の影響の分析 | |
| ◇ 第3節 | 臨床試験の倫理をどう捉えるか | |
| ◆ 第5章 総 括 | ||
| ◆ 文 献 | ||
| ◆ 表 | ||
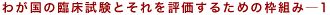 へ へ |
||
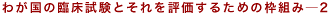 へ へ |
||
第2節 新GCP導入の影響の分析
Table 4-1の枠組みを用いて,新GCP導入の社会への影響を議論することができる。
新GCPの実施は,費用負担者(被験者,企業,医師)のすべてに追加的な費用負担(資源の消費)を強いる。 被験者にとっても,たとえば,新GCPにより要求される時間のかかる事務手続きは一種の負担となる。 医師や患者に発生する追加的な時間費用は,理論的には適切な方法で推計することも可能である49)49)Gold MR, Siegel JE, Russell LB, et al., editors. Cost-effectiveness in health and medicine. Chapter 21. Oxford: Oxford University Press, 1996: 188-208.。 費用の中には,最初の数年だけに発生する,いわゆる‘first-copy cost’もあるが,これを分析に含めるべきかどうかには議論がある49)49)Gold MR, Siegel JE, Russell LB, et al., editors. Cost-effectiveness in health and medicine. Chapter 21. Oxford: Oxford University Press, 1996: 188-208.。
一方,便益に目を向けると,新GCPの導入は,被験者に生じる臨床試験の直接の便益(本章第1節第2項に示した第一の便益), 特に医療従事者と患者の関係を深め,患者の満足度を高めることによる価値が期待される。 一般的な意味での被験者の権利の尊重の向上も評価する必要があるが,その評価は,現在の被験者のみでなく, 将来被験者になりうるすべての国民を念頭において行うべきであろう。第二の便益たる試験の成果の総括報告書や論文の価値は確かに上がるだろうが, その大きさをどう評価するかは難しい。新GCPが将来の医薬品市場に医療上有用な医薬品を多数導くことになるかについては確かではない。 しかし,1997年前後に著しく落ち込んだ治験届の件数をみると,特に短期的には,新GCPの導入は新薬の開発を一時停滞させることにより, 医薬品開発の「障壁」となっている可能性が高い11)11)Ono S, Kodama Y. Clinical trials and new good clinical practice guideline in Japan.Pharmacoeconomics 2000;18:125-41.。
歴史的に,日本の保険薬価制度における新薬の薬価の付け方が,いわゆる‘me-too drug’を次々に市場に送り出すインセンティブとなっている 可能性はたびたび指摘されているが30)30)Ikegami N, Mitchell W, Penner-Hahn J. Pharmaceutical prices, quantities and innovation. Comparing Japan with the US. Pharmacoeconomics 1994; 6: 424-33., もし,この開発トレンドが今後も続くようであれば,新GCPの導入の有無にかかわらず本章第1節第2項に示した第三の便益はあまり大きいものではなくなる。
1960年代の米国においては,いくつかの法律が導入され,医薬品規制が強化された。 FDA長官は,そのような規制強化の意図を「企業が‘me-too variants’を開発することを妨げるため」と明言している 50)50)Scherer FM. Industry structure, strategy, and public policy. New York (NY): HarperCollins, 1996.。しかし,日本の厳しい薬価規制の中では,医薬品の開発段階における同様な意図がどの程度達成されるかは明らかではなく 51)51)南部鶴彦. 医薬品の産業組織: 薬価規制の経済的効果. 医療と社会 1997; 7(1): 3-15.,「‘me-too drug’の開発が新GCPの実施により減る」とする論調は,やや希望的すぎると考えられる。
第1項 社会的な費用
以上の考察を踏まえると,特に便益をめぐる不確かさから, 少なくとも経済学的な枠組みから新GCPの導入の便益が費用を上回るかについての明確な結論は得ることは現時点では困難である。 また,そうした結論を得るためには,今後の長期的な医薬品市場の観察が必要であろう。
無論,効率性のスタンスからの議論のみならず,別の観点,たとえば,倫理や道徳上の価値観から新GCPの意義を評価することはきわめて重要であり, その際にどのような方法論が採用されるべきかは興味深いところであるが,本論文ではこれ以上の言及は行わない。 ただし,Table 4-1に示した枠組みが臨床試験の倫理を議論するうえでも有用な道標たりうることは,第3節において述べる。
第2項 分配的な観点