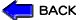■JPT-online■

治験環境の変化
私は平成11年8月末まで医薬安全局審査管理課におきまして,GCPの普及,定着にかかわってまいりました。本日の話題は臨床試験全般にわたると思いますが,その一部である治験を中心としたお話をさせていただきます。現在,臨床試験は非常に大きな変革期を迎えており,この変革の推進が,今後の臨床研究の体制整備そのものにつながっていくものと考えています。
ご存知のとおり,平成 9年 4月から実施された新 GCPの主な変更点は,文書によるインフォームド・コンセントの取得,治験総括医師制度の廃止,治験依頼者の責任体制の強化,治験審査委員会の機能の充実,治験責任医師の責任の明確化,実施医療機関における治験支援体制の充実などです。市販後の臨床試験にも新GCPがそのまま適用されていますが,現実的には,目標とする体制の実現には難しい面もあり,各医療機関はもちろん医学界全体でも体制作りの推進に取り組む必要があるものと考えています。
新GCP施行後の治験の現状
年度ごとの治験届の集計を表1に示します。新有効成分の初回治験届については,平成4〜8年にはコンスタントに100件程度ありましたが,新GCP施行以降の平成9年は82件,平成10年は65件となっています。また,2回目以降の届出の数も,平成10年には非常に減少しています。これは新GCPの導入による影響であるといえます。
| 年 | 新有効成分 初回治験届 |
新投与経路等 初回治験届 |
n回届 | 開発中止届 |
|---|---|---|---|---|
| 平成4 | 129 | 1054 | ||
| 平成5 | 160 | 1040 | ||
| 平成6 | 115 | 965 | ||
| 平成7 | 104 | 678 | ||
| 平成8 | 95 | 627 | ||
| 平成9 | 71 | 11 | 418 | 34 |
| 平成10 | 54 | 11 | 314 | 67 |
治験実施体制の調査結果
1 実施医療機関の体制整備
平成10年12月に,「治験を円滑に推進するための検討会」で,治験を行っていると考えられる大規模な医療機関を中心に実施したアンケート結果を示します。対象は約620施設で,約480施設から返答を得ました。
まず,手順書の用意については,「すべての業務について設定」と回答した施設は6割程度でした。「重要な業務に関してだけ」と「ほとんど,またはまったく行っていない」という回答が2割ずつで,全体の8割程度が何らかの形で手順書を用意していました。この回答結果は,施設が将来的に治験を行うかどうかということを判断した結果も反映していると考えられます。
医療機関の支援体制の充実という観点から新GCPにおいて設置が義務付けられた治験事務局については, 回答した約480施設の7割にあたる,約300施設が設置していました。さらに,その300施設に「治験管理室」を設置しているかどうかも質問してみましたが,こうしたスペースを置いている施設は全体の20%未満で,約70〜80ヵ所にしか設置されていませんでした。なお,「治験管理室」とは,治験事務局を設置するスペースのほか,臨床試験にかかわる,さまざまな機能を果たしうるスペースを意味する言葉として,仮に使っています。
2 モニタリング
このアンケート調査において,新GCPで治験の実施にあたって義務づけられたモニタリングについて,特に項目を設けております。このモニタリングにつきましては,治験依頼者,実施医療機関双方にとって,解決すべき大きな課題と考えております。回答のあった治験にかかわった経験を有する約800名の医師のうち,「モニタリングを受けたことがある」という回答が4割で,「受けたことがない」は6割でした。モニターへの対応については,「受けたことがある」と回答された医師のほとんどが「自分で行っている」と回答しており,医師本人が直接対応しているのが現状です。
次に,1治験におけるデータの確認頻度についても質問しましたが,「1カ月に4回以上」という回答は非常に少なく,「1カ月に 2〜3回」も10パーセントを少し超える程度で,1カ月に 1回程度という回答が最多でした。また,症例あたりの確認に費やす時間についてですが「10分以下」と「11〜30分」という回答が多くみられました。これは,予想に反して短いものでありました。
モニターのデータ確認については,「治験進行中に随時」という回答が半数を超えていましたが,「症例について治験が終了した時点」が約2割,「治験が全症例終了した時点」が約1割となりました。モニタリングの時期については,まだ改善していく努力が必要であろうと考えられます。職員の立ち会いについては,「作業中ずっと立ち会う」は少数で,「基本的には立ち会わない」が6割を超えています。最初に提示した資料をモニターに渡し,みてもらうことがモニタリングの方法となっていました。
モニタリングの問題点については,予想どおり「治験医師が忙しくなりすぎる」が最も多く,結局医師サイドからの要望としては,治験コーディネーターの導入による,医師の負担の軽減措置が求められているということです。なお,回答があった480施設の中で,治験コーディネーターを設置している施設は約15%でした。医療機関の負担にいかに対応していくかが,今後の適正なモニタリングの重要な要素になるものと考えられます。
「治験を円滑に推進するための検討会」による施策の提言
平成9年4月の新GCPの施行後,治験が進みにくくなったという指摘を受け,平成10年2月に医薬安全局に「治験を円滑に推進するための検討会」が,設置されました。この検討会は,関係団体,学識経験者等の代表18名からなる会議で,検討内容として治験コーディネーターの養成体制の検討,被験者の協力を得るための施策の検討,一般への普及,啓発の推進のための検討などを挙げておりました。しかしながら治験を推進するための課題について,広くご意見をお願いいたしました。厚生省としても,当検討会のご意見については,その都度実施に努めていくこととしました。また,検討会のもとにワーキンググループを設置し,平成10年度に財団法人日本薬剤師研修センターの主催により実施された「治験コーディネーター(CRC/SC)要請モデル研修」のカリキュラムについての検討,治験実施体制調整の実施,普及啓発ビデオの作成を行っていただきました。さらに活動のまとめとして,平成11年6月に治験を進めるための提言をまとめていただいております。この提言で治験が進みにくいことの基本的な分析として,被験者の参加を得るための体制の整備と,医療機関の治験実施体制の整備という2点の大きな課題が挙げられ,それぞれについての施策の方向性についての整理が行われました。
被験者の参加を得るための施策については,(1)国民の治験に対する理解の促進,(2)被験者募集のための情報提供活動,(3)被験者に対する診療体制の整備,(4)治験終了後の治験薬の継続提供,(5)治験参加に伴う負担の軽減が骨子となっています。
1 被験者の参加を得るための施策
1 )国民の治験に対する理解の促進
治験の意義について,自ら進んで被験者となり,心身の負担を背負うことの不安感,抵抗感があり,広く理解されているとはいえず,また,不適正な治験にかかる事件の発生により,治験に対して悪い印象を招いている面もあることが指摘されました。治験の正しい理解を促進するため,行政,関係団体,医療機関等が幅広く広報活動を行うことが期待されます。その一環として,検討会のもと,普及・啓発ビデオの作成なども行われました。
2 )被験者募集のための情報提供活動
現在のところ,国民が個々の治験の情報に触れる機会はほとんどないと考えられます。このため,薬事法,医療法上抵触しない範囲で積極的に情報提供を行っていくという提言が行われています。
具体的には,薬事法の場合は,治験薬は商品名を特定しない範囲,すなわち,治験の対象とする疾病名,製薬企業名等の情報提供を行うことは可能です。他方,医療法は,医療機関外に,治験実施の広告を規制していますが,医療機関内では可能としています。例えば「当院では高血圧の治験を実施中ですので,興味のある方は治験管理室にご連絡ください」といった掲示は可能です。
また,治験依頼者については,現在一般国民向けに,全く治験の情報提供を行うことはないものと考えられますが,先に述べましたように,両法律の規定に基づきますと,予定される商品名と治験を行う医療機関名を明らかにしなければ情報提供活動はできます。
なお医療法における医療機関外への情報提供に関しては,医療審議会で検討が行われており,その検討結果が注目されます。
3 )診療体制の整備
被験者に対する診療体制の整備については,各医療機関の工夫によって体制や環境の整備が行われることが望ましいと提言されました。
たとえば,
(1)被験者の外来診療を主に行う治験センターや,治験診療部門の設置
(2)被験者への予約診療の活用
(3)相談体制の拡充と相談室等の設置
(4)被験者への来院日確認のための連絡等の適切な働きかけ
などが例として挙げられております。
4 )治験終了後の治験薬の継続提供
治験参加により,他の方法で代替できない大きな効果が認められた場合には,その被験者の方がその治験薬の使用の継続を希望されることもあると考えられます。治験終了後の治験薬の継続提供については,検討会における議論を受けて,平成10年12月に「医薬品の承認申請後の臨床試験の実施の取り扱いについて(医薬審第1061号)」という医薬安全局審査管理課長通知を出しています。従来は一部のものを除き,治験がすべて終了した後で承認申請を行っていた関係で,治験が終了すると,治験薬の使用も終了されることとなっていました。今回の通知では,承認申請後も,長期投与の影響を見るなどの目的で治験薬を使用できるようにしたものです。もちろん治験としての取り扱いのなかで行うものですので,事前の治験届けの提出は必要ですし,新GCPの適用下に実施されます。治験終了後に治験薬を無制限に配布することにしたわけではありません。今後この取り扱いが適宜活用されることを期待しております。
5 )被験者の負担の軽減
治験参加に伴い,被験者に物心両面の種々の負担が発生することも否定しえないことから,実際にかかった費用も勘案しつつ,治験審査委員会の承認を得たうえで,社会的良識の範囲内で適切な金銭などの支払いが考慮されることは適当である,とされました。これを受けて,厚生省保健医療局国立病院部からは,7月2日付けで標準的な額を示す通知が出されております。
金銭などの支払方法は,受託研究費で積算し,治験依頼者から実施医療機関を介して被験者に支払われることが原則とされております。
例外的な支払方法としては,実施医療機関が治験依頼者から一時的に預かり,治験者に支払うという方法も言及されました。しかしながら,この方法は,実施医療機関,治験依頼者ともに契約や会計上の取り扱いが不明確になりやすいことや,治験参加にかかる個人の情報が,請求において治験依頼者に流れていく可能性などがありえます。したがって,治験依頼者と実施医療機関の管理責任体制の明確化が必要となります。この方法は,被験者間での差をつけないためや,時期的に難しい場合などを考慮したきわめて例外的な考え方とみなされています。
2 医療機関の体制整備の施策
こちらにおきましては,1)医療機関内の治験実施体制の確立等,2)治験コーディネーターの育成・確保,3)治験審査委員会の機能強化,4)治験事務機能の強化,効率化,5)診療所医師の治験参加が骨子となっております。
1)医療機関内の治験実施体制の確立,治験を担当する医師および歯科医師の資質の向上等
治験実施体制の確立には各関係部門との連携が重要で,このためには医療機関の長の役割が非常に大きいとされました。また医師および歯科医師の資質の向上として,卒前教育等における臨床薬理学および臨床疫学の教育の充実や,治験に関する研修の推進の重要性も述べられています。治験に参加するインセンティブを向上させる必要性がいわれていますが,そのため業績の評価,研究費の効果的な配分等,各医療機関の工夫についても触れられております。
2)治験コーディネーターの育成・確保
治験コーディネーターの必要性についてはこれまで多くの講演会などでも取り上げられてきておりますので,徐々に理解も広まってきているものと思います。検討会の提言では,治験ということに焦点があてられていたため,この呼称で整理されました。しかしながら市販後臨床試験や,臨床研究にも関わることがありえますので,将来的に役割がどんどん増えていった場合に,いずれ呼び方を見直すこともあると考えられます。また,平成9年度厚生科学研究「新GCP普及定着総合研究」の報告書でも,基本的にはそのスタンスをとっています。なお,CRC(Clinical Research Coordinator)という表現につきましても,概念的に治験コーディネーターよりも広いものであることから,同義語としての使用を避けるべきとされました。この治験コーディネーターについては,すでに関係団体,行政による養成研修が行われておりますが,よりいっそうの理解,そして,治験コーディネーターどうしの連携も必要と考えられます。特に,研修終了者があまり治験の業務に携わっていないという実態から,いかに実施医療機関内で活用していくか,その体制整備の点が,大きな課題ではないかと考えられます。
3)治験審査委員会(IRB)の機能強化
IRBの機能強化については,平成10年度厚生科学研究「医薬品の臨床試験の基盤整備に関する研究」である程度実態調査が行われ形式的には整ってきているものと考えられます。今後審議内容の充実という大きな目的のために,実施医療機関が共同で活用できるものの設置等これからの方向性については検討を進めるべきという提言でした。
4 )治験事務機能の強化,効率化
治験事務機能については,治験事務局に課せられる治験依頼者との連絡調整,多数の文書の保存・管理,治験依頼者によるモニタリングおよび監査への対応などの業務をこなすための強化・効率化を図ることが必要であり,このための人員の確保,場所や設備の確保の必要性が述べられております。また,今回は初めて,SMO(Site Management Organization)について言及されております。SMOについては,治験を行う医療機関の判断でその業務を委託するという意味では,GCP上のCRO(Contract Research Organization)とは位置づけが異なるものとなります。詳細については,平成10年度厚生科学研究「医薬品の臨床試験の基盤整備に関する研究」報告書中に考察が述べられています。
5 )診療所医師の治験参加
診療所医師については,より円滑に治験や市販後臨床試験を進めるという観点から治験への参加が期待されます。しかしながらこのためには環境整備,たとえば,病診連携の推進,IRBの活用,事務機能への対処などが必要であり,今後の体制整備が課題となります。
厚生省による施策の実施状況(表2)
表2 治験を推進するための施策(平成11年度)