
栗田 次に 1 次予防に関して,疾患別に適応を考えていきます。 まず冠動脈疾患(CAD)について MADIT(Multicenter Automatic Defibrilla-^ntor Implantation Trial)-II の結果が昨年(2002)出ました。 その前の MADIT-I と併せて考えますと,CAD に対する ICD の 1 次予防の適応がかなり確立されてきたと思います。 2002 年の AHA/ACC ガイドラインでは MADIT-II に該当する患者の ICD 適応をすでに認めています。
MADIT-I と MADIT-II では(図2)生命予後改善率にかなり大きな差があります。 MADIT-I は 54%,MADIT-II では 30%です。 この大きな違いは,ICD 群の予後には差はないのですが,対照群で MADIT-I が非常に悪いので,それが総死亡の改善率の差として反映されたのです。 こういうハイリスク群を同定するためにはやはり EPS が必要で,MADIT-I と MADIT-II の大きな違いは,EPS をスクリーニングに使っているか,いないかということです。
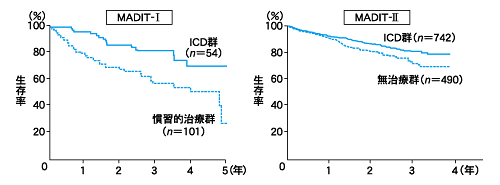
池口 ICD が不整脈死亡をどれだけ減らしたかといえば,MADIT-I では 75%,MADIT-II では 61%とだいたい有効性は同じでした。 それに対し,全死亡については MADIT-I の ICD 治療群は 54%低下,MADIT-II では 31%しか低下しませんでした。 裏返してみれば,心機能が悪いために心不全死が増加する,または不整脈,VF が起こったときに ICD が無効になることも考えられます。 LVEF の低いグループが対象のため,純粋な不整脈死以外のファクターが高くなり MADIT-II における全死亡の ICD による改善率は低いのではないかと思われます。
栗田 MADIT-IIでは LVEF が悪い人を登録しているから不整脈死以外のファクターが強くなり,MADIT-II のほうに心不全死が多い結果になった。 つまり,不整脈死についての効果はあまり変わらないかもしれないということですね。
栗田 庄田先生,先生方の東京女子医大が中心にまとめておられる CAD の予後に関するデータは非常に重要なものですが,それについてお話し下さい。 というのは,特にCAD を中心に扱っておられる先生方には「日本ではこんなに死亡率は高くないし,無治療群の予後がこれほど悪いはずがない。 MADIT-II は日本人には当てはまらない」という意見があるからです。
庄田 私たちは女子医大およびその関連病院で急性心筋梗塞(AMI)の患者 3000 例を登録し, それを前向きに調査した結果,心筋梗塞後 1 年間の不整脈による突然死の死亡率は 0.9%でした。 日本で行われた非介入の前向き調査では初めてのものだと思うのですが,アメリカの MADIT-I,MADIT-II のデータと比べて日本人の虚血性心疾患(IHD)患者の不整脈による突然死の死亡率は欧米の約 1/10 と考えてもよさそうです。 したがって,今回の AHA/ACC の新しい ICD 植込みのガイドラインでは予防的植込みということが IIa に入っていますが, それをそのまま日本人の疾病構造に当てはめることはできないと思います。
私たちはそういうデータをもちながら,かなり積極的に植込みを考えている施設だと思います。 その理由の 1 つは,インターネットの普及で,患者が MADIT-I,MADIT-II のデータを見て知識が豊富であるからです。 5 年前に比べれば,患者のほうから ICD を希望するくらい積極的になりました。
もし最初の発作が起きる前に ICD が埋め込まれており,そのため救命できたということになると,それは客観的なデータとして私たちが学習することになりますが, もし入れないで,突然死した場合は何も得られませんし,何よりも,患者の死が悔やまれます。 ですから,MADIT−I とわれわれのデータをみて日本人は欧米人とは違うのだということがわかっているものの, そしてそれが約 1/10 の確率であっても突然死を防ぐために植込みを考えています。 ただ,5 年,10 年後のリサーチで,「日本人には ICD を入れなくてもいい」という結果が出れば,そのときには私たちの基準は変わってくると思います。
栗田 日本人の MI の予後が欧米人に比べてかなりいいということは喜ばしいことですが,その理由は何でしょうか。
庄田 1 つは,日本の医療がきめ細かいということです。治療も患者のフォローアップも非常に丁寧です。 もう1 つは基本的にコレステロールの値はもともと日本人のほうが低い。 また,日本人では初回発作の場合でも多枝冠動脈疾患の確率は低いですね。 それ以外の肥満,高血圧などさまざまなサードファクターがありますが,そういった疾病構造からして違うと思います。
栗田 大変貴重なデータですね。これをもとに今後の研究の発展を願っております。
栗田 青沼先生の施設では AMI に対する EPS が予後を予見するかどうかという研究をされました。 その結果と,先生が推奨される CAD に対する ICD の 1 次予防についてのお考えをお聞かせ下さい。
青沼 われわれの施設では 1980 年代に 4 週間以上経過した MI について EPS を行ったところ, 約 30%で VT が誘発されました。LVEF がいい人も悪い人も,VT の器質をもっている頻度は同じぐらいでした。 しかし,それを前向きに調査すると,突然死や新しく VT が認められた症例は,やはり LVEF の悪い群に多かったです。
栗田 例えば MADIT-I では EPS で誘発された患者に慣習的治療を行った場合の予後は 3 年で 40%死亡と,非常に悪いものでした。 先生方の場合は,MADIT-I に比べてどうですか。
青沼 だいたい3 年で 10%の死亡でした。
栗田 ということは,そういう患者に関しても日本人ではまだ予後がいいということですね。
青沼 そう思います。それに関して庄田先生のお話にもありましたが,われわれも東京医科歯科大学で,前向き試験を行っています。 そのデータでも,やはり突然死や心臓死,総死亡率というのは,1 年で 8〜9%とか 3 年で 40%というような大きな数値ではありません。 その理由は,先ほども出た日本人の器質,例えば多枝冠動脈疾患が少ないとか高脂血症の程度が違うということもありますが, アメリカでは EBM に従って,例えば AMI に t−PA がいいということになれば t−PA を投与して,4 日〜1 週間病院で診て,その後は家に帰す。 造影をしないことも多いわけです。 ところが日本では,AMI の患者が来院した場合,6 時間以内であれば必ず revascularization(血管再建術)を行います。 つまり,治療のきめが細かい。一人ひとりに対するテーラーメード医療を以前から実践しているのです。 例えば半年,1 年おきに RI(ラジオアイソトープ)を使って新しく虚血が起こっていないかみます。 虚血があれば,intervention group の先生方はすぐに入院させ PTCA を行ったりします。 このように,すぐれた治療を前向きにしているために,それが予後の改善につながっているのではないでしょうか。
栗田 つまり,CADを中心にみている先生方が,患者が私たちのところに来る前に治療しているという,非常に重要なことですね。
栗田 LVEFが悪い CAD 患者に対する,ICD の 1 次予防的適応を考えるうえで,非持続性 VT をみるかどうか,EPS や薬効評価をするかどうか,どのようなものでしょうか。
青沼 私どものところでは,1 枝病変でも revascularization を行った後,リモデリングが起こって心機能が悪くなっている症例があります。 それで,基本的に 1 枝病変でも多枝病変でも LVEF の悪い症例に関しては LP(late potential)をとって陽性であれば,EPS を行うことが多いです。 それで非常に容易に持続性の VT もしくは VF が誘発されるということになれば,患者に話して 1 次予防で ICD を植えることがあります。
栗田 非持続性 VT のある,なしに関係なく,加算平均心電図のほうが最初になるわけですね。
青沼 はい。そういう LVEF の悪い人にはホルター心電図記録では 2 連発,3 連発ぐらいの非持続性 VT はだいたいあると思うのです。
庄田 私はホルター心電図をみて EPS をするかどうかを決めます。もちろん加算平均心電図も参考にしますけれども。 ホルター心電図では連結期と連発数を重視します。 例えば 3 連発以上の非持続性 VT があって,RR 間隔が 300 msec を切るような状況ですね。
栗田 そのような患者では,LP 陽性,陰性には関係なく EPS を行うということですか。
庄田 はい。データを蓄積することによって,それが本当に正しいかどうか証明されていくと思います。
池口 私も基本的にはホルター心電図で非持続性 VT があるかどうかをみて EPS の適応を決めるという,庄田先生の意見と同じです。
栗田 先ほどの MADIT-II の心不全死が多い結果からすると,EPS の役割というのはどうなのでしょうか。
池口 日本の IHD はアメリカの IHD とは違うという議論がありました。 CAT Study(Cardiomyopathy Trial)の成績から,ヨーロッパでもアメリカでも,最近,DCM は IHD とは違うという認識が出てきています。 ということは,これはまったくの推測ですが,日本の OMI はアメリカの DCM に近いと考えることもできます。 同じアメリカでも IHD 群のなかの,LVEF が中等度の症例に関しては EPS の有用性が高い。 しかし,LVEF が 30%を切るような悪い症例では必ずしも EPS で誘発されなくても,不整脈死の危険度が高い。 むしろ,LVEF 40%で誘発されるよりも 30%で誘発されないほうが危険だと,アメリカでの比較では結論づけています。 恐らく LVEF 30%以下で EPS で誘発される,または洞調律時の QRS の幅が広いなどの条件が重なっている例に関しては,日本の IHD でもある程度危険性が高いのではないか。 つまり LVEF の低い群でも EPS の重要性があるのではないかと思います。
栗田 わが国においては重症患者の割合そのものが少なく,それが予後の良さにつながっているのかもしれない。 しかし,ハイリスクグループでは予後の悪さは同じだろうということですね。それをきちんとみつけることが大切ですね。
庄田 私たちは実際の治療方針を考える場合,EBM の立場では,いろいろな mass study を参考にします。 しかし逆説的な考え方ですが,2 つの治療を比べて,一方が 5 年間で 70%の人が生きている,他方は 50%しか生きていない。 では,50%しか生きていない治療法は悪いのかというと,その治療法でも 50%の人は生きているわけです。 先ほど青沼先生がテーラーメード医療ということを言われましたが,例えば有効率が 10%しかない抗癌薬があったとします。 たとえ 10%の有効率しかない治療法であっても,その 10%に相当する人にとってはその治療法が非常にいいのです。 EBM というのは 1 つの指針として大切ですが,治療にあたっては個々の患者の特殊性をもっと考えなければなりません。
栗田 つまり,mass study の結果だけを知って治療をすると間違う可能性がある。 患者がその mass study のなかのどの領域に当たるのかということを知ること, 例えば MADIT-II でもいろいろなサブグループ解析があるので,そういうファクターをしっかりつかむことが大切だと思います。
庄田 MADIT-II は非常にセンセーショナルな結果で,一般的に「不整脈発作がなくても LVEF が悪い人は,突然死のリスクが高い。 そこで ICD を入れることによって死亡率が減る」というエビデンスが明らかにされたため, 極端なことをいえば「LVEF が 35%以下の人に ICD を入れないで退院させて,その後突然死したら訴えられてしまう」可能性がある状況を招いてしまったわけです。 しかし,例えば 30〜35%の人はそんなにリスクはない,20%以下の人は非常にリスクがある,など,そのへんをもっと層別化して細かくみるべきです。 EBM はセンセーショナルな結果だけが先走りしてしまう傾向がありますので,非常に注意が必要です。
栗田 最終的な結果だけをみずに,患者に合った情報を的確に把握することが大切ですね。
栗田 池口先生,CAD の 1 次予防を考えるときに EPS をされるとおっしゃいました。 そのときに 2 連発で誘発された場合と 3 連発で誘発された場合で予後は変わるのか。 あるいは,単形性持続性 VT が誘発された場合と,先ほど問題になりました VF が誘発された場合,それぞれの特異度,感受性についてはどのようにお考えですか。
池口 例えば Brugada 症候群で実際に VF を起こした方と無症候性 Brugada 症候群で EPS で誘発される方がいるとします。 無症候性 Brugada 症候群で 2 連発で簡単に VF になる場合もあれば,実際に VF を経験していながら,3 連発をかなりしつこく入れないと起こらない場合もあります。 そうすると,2 連発と 3 連発の実質的な差は果たしてあるのだろうかという疑問をもつのですが,その最終的な解答は私にはわかりません。
従来,私個人はベースラインで通常の 2 連発,3 連発の連結期で入れて持続性 VF になるものに関しては, ホルター心電図で連結期の短い非持続性 VT が実際に起こっている場合にはかなり危険なのではないかと考えています。 単形性のものと多形性のもので意味が違うのかどうか伺いたいと思います。
庄田 それこそエビデンスがないので,個々に対応するしかありません。例えばホルター心電図上で連結期の短い非持続性 VT がある。 それと同じような連結期でペーシングを加えたとき,2 連発でも 3 連発でも VF が誘発されれば,「VF だから非特異的です」ということにはならないと思うのです。 このような場合にはケースバイケースで,ICD の適応を考えます。
栗田 青沼先生は CAD に対する EPS のスタディをなされましたが,VF と VT の患者で予後が違うということはありましたか。
青沼 むしろ LVEF のよいケースに多形性 VT〜VF が誘発可能であった症例が多かったのです。 だから,VF の誘発は必ずしも非特異的ということではありません。
栗田 とりあえずの結論として,CAD に絞ってみますと,1 次予防的に ICD の適応を考えるときには EPS を行う。 EPS を行う基準としては LVEF が 30〜40%以下,ホルター心電図での非持続性 VT,加算平均心電図での LP を参考にする。 誘発を目的とした期外刺激は 3 連発まで 2 ヵ所から行い,持続性 VT あるいは VF が誘発された場合には ICD の積極的な適応を考えてもいいということですね。
庄田 特に低心機能の CAD 患者で徐脈があってペースメーカーが必要な方は,私たちは積極的に ICD にしています。 DDD の適応だったら dual chamber ICD,VVI の適応だったら single chamber ICD を入れます。
池口 同じデバイスを入れるのなら,ICD を入れたほうがいいということですね。
栗田 それも1 つの考え方ですね。
栗田 次に非虚血性心筋症,特に DCM の 1 次予防についてですが,昨年(2002),CAT Study が発表されました(図3)。 これは 1300 例ぐらいを登録する予定でしたが,非 ICD 群,つまり無治療群の予後があまりにも良すぎて, 結局有意差が出ず,100 例で中止になってしまいました。その長期予後についても,ICD の予後改善効果は否定されました。 この結果によって,DCM に対する ICD の 1 次予防効果はないとお考えになりますか。
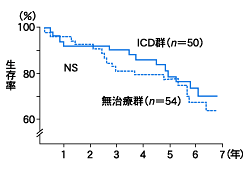
青沼 DCM に EPS を行うと,VT の誘発性は虚血性に比べて非常に低い。 私は DCM に対する EPS の有用性は虚血性の CAD とは少し違うと思います。
過去に,clinical に VT が認められた症例でアブレーションを施行した例が 1 例だけあります。 その症例では再発はありませんでしたが,当人の希望で ICD 植込みを行い,その後 5 年間フォローして,最終的には CHF(congestive heart failure)で亡くなりました。 この例では心不全末期にのみ VT が再発しました。 心機能が末期的な状況になると不整脈の出現がひどくなる例が非常に多く,心機能が比較的保たれているときには,VT のコントロールが比較的良好なことが多いようです。
庄田 女子医大のデータではβブロッカー,ACE 阻害薬,ARB などによる薬物治療,さらに両心室ペーシングという,いま考えられる内科的治療をすべて行うと, DCM による重症心不全患者における 3 年間の全死亡率は 10%以下です。 私たちは心臓移植施設ですから,他院と比較して重症患者が集まってきます。 平均の LVEF が 23%くらいだと思いますが,それでも 3 年間の死亡が 10%にも満たない。 いまから 15 年以上前の成績では平均 LVEF が 30%強の患者に対する治療にもかかわらず,3 年間の死亡率は約 20%でした。 それでは,この間に積極的に ICD が移植されたかというと,そうではない。 心不全に対する ICD 以外の内科的治療で,これだけ生命予後がよくなったということを学ばなければなりません。
内科治療+ICD の場合,どの程度生命予後を改善できるかデータはありませんが,女子医大では今までに 1 次予防として ICD を植え込んだ患者が約 20 人います。 植込み基準は,ホルター心電図上,非持続性 VT があり,それと似たような連結期での EPS で VF が誘発された場合です。 フォローアップは平均で 2 年弱,2 人に適切作動がありました。 まだ症例数も少なくて,それを根拠に皆に勧められるというものではありませんが。
栗田 池口先生,DCM で 1 次予防を考える場合,EPS の役割は同等のレベルでしょうか。 それとも,DCM のほうが EPS の予見性は低いとお考えですか。
池口 基本的に DCM では誘発性が低いので,ハイリスクの患者を積極的に非常に広範囲に EPS でピックアップできるとは思いません。 ただ,庄田先生のように,実際に非持続性 VT が出ていて,EPS を行うと同じ条件で VF になるという症例については,予防的に ICD を使った方が何人かいます。
なお,CAT Study は否定的な結果に終わりましたが,純粋な ICD Trial とは少し異なる COM-^nPANION Study(Comparison of Medical and Defibrillation Therapies in Heart Failure)が終了して肯定的なデータが出たと, 先日の香港での世界心臓ペーシング・電気生理学会で発表されました。 このスタディでは QRS 幅が 0.13 秒以上,PR 時間も 0.15 秒以上と広く,かつ NYHA III〜IV 度が対象になっており,重症の方を対象としています。 それによると,総死亡は適切な薬剤治療群と比較して両心室ペーシングの群で 20%,ICD+両心室ペーシングの群で 40%減少したということです。 そういう条件では ICD とか ICD+両心室ペーシングの予防的植込みの有用性があるのではないかと思います。
全般的に DCM においても洞調律時の QRS 幅が広いとか非持続性 VT が出ている, 心房細動が合併しているなどの患者に関してはハイリスクではないか,とドイツの Klein 先生も世界心臓ペーシング・電気生理学会で報告されています。 MADIT-II のデータもそうですが,いろいろな項目の因子をみていくと,ある程度危険なグループが浮かび上がってくるようです。
栗田 大変重要な情報ですね。いずれにしろ,DCM に対する 1 次予防を判断するにはもう少し新しいデータの蓄積が必要のようです。
栗田 わが国では Brugada 症候群が非常に多く, ICD で有効な患者の 2〜3 割は Brugada 症候群です。 有症候性の場合には ICD の使用が一致した意見だと思うのですが,無症候性 Brugada 症候群に対する ICD のしっかりした適応基準がありましたら教えてください。 特に EPS の誘発性などについてのご意見をお願いします。
庄田 まず無症候性 Brugada 症候群の患者,いわゆる Brugada 心電図は 30 代,40 代の男性では,およそ 1〜2%です。 家族歴とか遺伝子といった方向でも研究がされています。例えば原因不明の失神発作, 動悸発作などが起これば迷わないのですが,それ以外に,加算平均心電図,房室伝導系異常など, 「こういった所見があれば,これぐらいのリスクがある」ということはまだわかっていないのです。現段階では個々にみていくしかありません。
私は本人の意向を重視します。そのためにはまず,最新のデータをすべて患者に説明するようにしています。 わかっていないことについては「わかっていない」と正直に言います。 患者が 30 代,40 代で働き盛りの方が多いですから,本人が ICD を強く希望された場合,先ほども言いましたが, 「あなたには絶対に必要はないですよ」と言える根拠はありません。 患者の熱意に負けて ICD を入れるというケースはあります。
青沼 患者の意向というか,考え方は非常に大事だと思います。 ただ,日本医科大学の新博次先生のデータ(Atarashi H, et al. JACC 2001;37:^n1916−20)だとか Priori 先生のデータ(Priori SG, et al. Circulation 2000;102:2509−15)によりますと, 無症候性 Brugada 症候群の予後は良いですね。 3 年間のフォローで,Priori 先生では 0%です。 新先生のデータでは 1 人亡くなり,3%ぐらいでした。 ですから,無症候性 Brugada 症候群の人は 3 年ぐらいではほとんど死なない。 しかし,5 年,10 年になるとどうなるか。もう少し長期間のスタディが必要だと思います。
栗田 長期的なスタディということでは松尾清隆先生(長崎大学第三内科)が長崎と広島の被爆者 5000 人の患者を 40 年間フォローしたデータがあり, その突然死の発生頻度は新先生のデータとまったく同じです(Matsuo K, et al. JACC 2001;37:765−70.)。 年間で約 0.5%,200 人に 1 人が突然死ぬ,あるいはニアミスが起こっています。 3 年たてばもっと悪くなるかというと,そうでもなくて,一定の割合で起こっている可能性があります。
栗田 次に,EPSの有効性についてお聞かせください。
池口 Brugada 先生自身は「EPS は有用だ」と一貫して言っておられます。 一方,Priori 先生は最近の Brugada 症候群の治験に関して「必ずしも予後は EPS の誘発性とは関係しない」と報告されています。 なお,Priori 先生が当初“Circulation”に出された報告は青沼先生がおっしゃったように本当に死亡率が 0%ということでしたが,新しいデータでは 3 年で 20%程度のイベントがあったということです。
栗田 案外高いですね。急に20%ですか?
池口 ヨーロッパ心臓病学会としてのデータの膨らみがあると思いますが, 必ずしも突然死の家族歴のある人ばかりではなく, むしろ家族歴のない人が多い孤立性のものが Priori 先生のデータです。
イベントの種類は VF とか失神などの VF に近い状態を疑われるような自然発作ということでした。 驚いたのは,Priori 先生が「3 年で 20%は高いとはいえない。このデータで ICD を入れるのは費用対効果比がまだ不十分だ」と言われたことです。 私は 3 年で 20%なら,やはり入れておいたほうがいいと感じたのですが。
無症候性 Brugada 症候群の ICD の適応については,まず第 1 段階として EPS の誘発をみることです。 しかし,すでに発作を起こしている,VF から蘇生されている人でも 5〜6 年の観察期間でみていても作動はありません。 ですから,本当に 10〜20 年という長期のフォロー,30〜40 歳代に多く発症するわけですから, 40〜50 歳代までフォローしないと,予後に関する最終結論は出せないのではないでしょうか。
栗田 私どもでは,有症候性 Brugada 症候群の 44 例に対して ICD を入れており,3 年で 40%強の作動率です。 無症候性 Brugada 症候群に対して予防的に入れた患者ではほとんど作動がなかったので, 明らかに差がありました。やはりまだきちんとリスクが見極められていないと思います。
庄田 私もまったく同じ意見です。 私たちは 1 次予防として Brugada 症候群に ICD を入れた例が 15 例ぐらいあり,1 例だけ適切作動しました。 しかし残念なのは,作動する患者としない患者を区別する適切な手段が今のところないことですね。
栗田 私のところでは12 例で 1 例ですから同じような率ですね。
庄田 VF 発作の既往のある Brugada 症候群患者と右室流出起源 VT/期外収縮の患者と同一のプロトコールで誘発をすると,明らかに差があります。 われわれのデータでは Brugada 症候群では 60%以上に VF が誘発されますが,対照群では 10〜20%です。ということは,やはり EPS には何らかの有用性があるのではないかと考えます。 しかし Brugada 症候群の場合はベースラインの PVC や非持続性 VT はほとんどみられないので, どれぐらいの連結期でペーシングをしたら,適切な検査になるのかを判断する材料がなく,困っています。
栗田 私もよく,Brugada 症候群,特に無症候性 Brugada 症候群に対する適応を聞かれます。 全国各地の先生方からうかがった突然死例をみますと,家族歴や遺伝子背景,EPS 誘発性とか ST 上昇のパターンなど,どれ 1 つとして共通するファクターがみつかりません。 庄田先生の言われるように,EPS がきちんとリスク評価できるかどうかというのは非常に難しい問題です。
池口 Brugada 症候群の典型的な心電図をもっているのにまったく無症状な方をたまたま診たときに, 例えば EPS のこととか,Brugada 症候群はどういうものかという話をした後に EPS で誘発されると, 患者は多分,恐怖心をもった結果「じゃあ ICD を入れたほうがいいのかなあ」と考えてしまいがちです。 そのことを含めて,典型的な Brugada 症候群をみたら基本的に EPS を勧めるのか,むしろ勧めないのか, 例えば心房細動があって Class I の薬剤を使いたいときなら EPS をしようとするのか,どうでしょうか。
庄田 私は以前はリスクの話はまったくしませんでした。ところが,最近は誰でもインターネットで知ることができる時代になりましたので, 突然死のリスクの話をしないというのは医者にとっては怠慢と思います。 このような場合には私は患者ができるだけ理解しやすいように交通事故死亡を持ち出して話すことにしています。 無症候性 Brugada 症候群の人が亡くなる確率は,先ほど栗田先生は 0.5%とおっしゃいましたが,それよりもっと低いかもしれません。 ですから,「表を歩いていて交通事故で死ぬ確率は 1 年間当たり 0.01%です。あなたはこの確率を恐れて外を歩くのをやめますか」という話をします。 また,「タバコを吸うことによって命を落とす確率は Brugada 心電図で命を落とす確率よりもはるかに高い」といいます。 たまたまその人がスモーカーなら,「Brugada 症候群のことをくよくよ考えているぐらいならタバコをやめたほうが,あなたの生命予後にはとてもいいです」といいます。(笑)
そういう数字をまぜて,例えば 0.01%という確率が交通事故と同程度なのだとわかっていただくとすっきり納得するようです。 さらに,必ずフォローアップします。そうしないと,「こういう所見をもった患者がどういう予後をとるのか」ということがわからないのです。
栗田 将来のためにもそういうことをきちんとやっておかなければいけませんね。