高松赤十字病院薬剤部
福井直仁 Naohito Fukui
“システマティックレビューは,一般 的には,臨床試験論文をデータベース検索や参照文献リストなどによって収集し,そのデータを総括して評価する。それに対して,コクラン共同計画におけるシステマティックレビューとは,ある目的とする医学的介入についてのエビデンス(科学的根拠)を明らかにするために,世界中からの論文をあらかじめ定めた基準で網羅的に収集し,批判的評価を加え,要約し,公表するための方法である[1,2]。コクラン共同計画ではこのシステマティックレビューに厳密な方法論を定義しており,最新,最良のエビデンスを,継続的に提供しようとするものである。
本稿では,コクラン・システマティックレビューとEvidence-Based Medicine(EBM)[3]の関係と,一般 的なシステマティックレビューとの違いに注目しながら,その実施方法[4,5]を示すことにする。
コクラン共同計画では,共同レビューグループ(CRG)が医学的介入によってヘルスケアが改善するリサーチ・クエスチョンを提示し,そのプロトコールを作成するところからシステマティックレビューが始まる。プロトコールはシステマティックレビューを行う前に確立され,その過程は可能な限り厳格かつ適切に定義される必要がある。レビューのためのプロトコールには,カバーシート,背景,目的,選択基準,検索戦略,方法が含まれる。これはレビュー後の最終報告のドラフトともなる。
リサーチ・クエスチョンの構成要素として重要なのは,対象となる患者,医学的介入または暴露の形式,アウトカムの種類,研究の種類が特定化できることである。
“対象患者”は,興味の対象となる病気や状態が定義され,母集団や背景が同定されていなければならない。
“医学的介入”には,薬,外科手術,検査,看護,教育,サービスなどが含まれ,その内容は患者のヘルスケアを改善するものに限られる。EBMでは介入による害作用そのものをリサーチ・クエスチョンとすることがあるが,コクラン共同計画では害作用を減少させるための介入などがリサーチ・クエスチョンとなる。例外的に,改善効果 を見るためのリサーチ・クエスチョンの結果が害作用であった,というようなことは起こりうる。
“アウトカム”は,介入をインプットと考えたときに,この介入から得られるすべての結末である。余命の延長,死亡率の低下,発症の減少,副作用の減少などのポジティブなものと,余命の短縮,死亡率の増加などネガティブなものとがある。アウトカムを評価するための項目をエンドポイントという。エンドポイントは,患者が感じる状態を直接的に変化させるものでなければならない。エンドポイントとしては死亡,病気の発症,QOLの変化,副作用の発現などを用いるべきで,血圧,血糖値,癌の大きさなどは用いない。前者を真の(true)エンドポイント,後者を代理の(surrogate)エンドポイントと称する。
“研究の種類”として,コクラン・システマティックレビューで対象とする臨床試験は,ランダム化比較試験(randomized controlled trial:RCT)と比較臨床試験(controlled clinical trial:CCT,準ランダム化比較試験)に限っている。得られる結果 が一定のレベルを保ち,ユーザーがリサーチ・クエスチョンによらず,一定の信頼をおいて使えるようにするためである。一方,EBMでは,RCTやCCTのみならず,コホート研究,ケースコントロール研究なども用いられる。これらはリサーチ・クエスチョンによってRCTが存在しない場合があるためである。そのリサーチ・クエスチョンがRCTを行うだけの関心を集めていない場合,害作用を見るためにRCTを行うことが倫理的に問題のある場合,事象の発現率が小さくRCTが物理的に困難な場合などである。コホート研究,ケースコントロール研究などを利用する場合は,RCTやCCTと比較してエビデンスの証明力が弱くなる。
臨床試験を検索する場合,コクラン共同計画と一般 的なEBMとのいちばん大きな違いはデータの網羅性である。EBMでは,限られた時間と資源の中で効率よく臨床試験を検索することが求められる。それに対してコクラン共同計画では,網羅性が重要視される。
レビューする場合はまず,CENTRAL(コクラン比較試験レジスタ),MEDLINE,EMBASE,Science Citation Indexなどのデータベース検索と同時に,自己の所属する専門分野の雑誌,学会誌およびその参照文献リストより,関連する臨床試験論文を収集する。
実際に公開されたデータだけではデータの採択に偏りが生じる場合があり,これを“パブリケーションバイアス”と呼ぶ。有効性の認められなかった臨床試験は,発表を差し控えたり,雑誌投稿の査読段階で除外されることが多く,網羅性において特に問題となる。このようなパブリケーションバイアスを避けるために,レビューアーは学会抄録,製薬会社の社内資料,未出版論文などの入手,試験者への個人的接触などによって,できうる限りのデータ収集に努めなければならない。
システマティックレビューを行う場合のバイアスを最小限に抑えるために,組み込まれる個々の臨床試験を批判的に評価する必要がある。ヘルスケアの効果 をみる臨床試験においてみられる系統的エラーとしては,選択(selection),実施(performance),減少(attrition),発覚(detection)の4つのバイアスが知られている。最も結果 の妥当性に影響力が強いのがランダム割付けの隠ぺい(concealment)と盲検化(blinding)である。ランダム割付けの隠ぺいは,介入群と対照群の背景因子による系統的エラーを抑制し,盲検化することによって実施バイアスと発覚バイアスを減少させることができる。intention to treat解析は,試験開始時に組み込まれた患者全体を対象として行う統計的手法で,途中脱落者によって起こる介入群と対照群の間の背景因子の不均衡を生じさせない。
臨床研究の妥当性を評価する方法としては,評価ポイントを“あり”“なし”“不明”のように点数化して合計点数とカットポイントを比較する方法や,質評価スケール,チェックリストなどを用いる方法がある。疾患と介入によって,評価方法は基本的に異なるものであるが,簡略なものが望ましい。一般 的に用いられるのは,Shultz(1995)[6]やJadad(1996)[7]などによるものである。
データ収集フォームに基づいて,ソフトウエアや入力用紙を用いてデータの収集を行う。データ収集フォームの項目と形式は,コクラン共同計画で用いているデータ管理・解析ソフトのReview Manager(RevMan)に合致したものが望ましい。主な項目は,研究のタイトル,研究の出典と研究者名,研究の適切さの証明,研究の特徴(方法,対象患者,介入,アウトカムの測定と結果 ),数値データなどである。なお,研究デザインなどが不適切で包含基準に合致せず除外された研究も含めて登録している。
データは,RevManに内蔵している統計解析エンジンを用いてメタアナリシスされる。メタアナリシスとは,複数の臨床試験データを統合する統計学的手法である。データのタイプ(二値,連続),統合された統計値(オッズ比,相対危険度,リスク比,加重平均差),プールするモデル(固定効果 モデル,ランダム効果モデル)などによって計算方法が異なる。結果の統計値は表とグラフの形で,信頼区間(90%,95%または99%)を伴ってコクラン共同計画の表示ソフトであるMetaView上に表示される。MetaViewは,次号で詳述するThe Cochrane Libraryの結果表示にも使用されている。
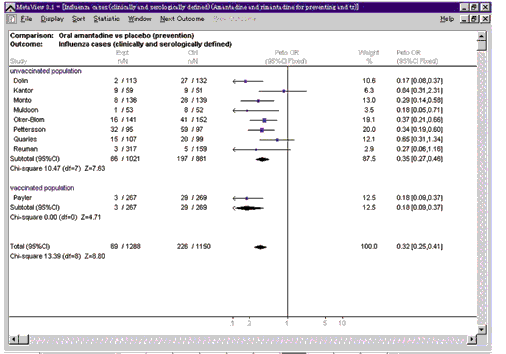
図1は経口によるアマンタジンの予防効果を,インフルエンザの発症(臨床的と血清学的)をエンドポイントにして行ったRCTの結果 をメタアナリシスし,MetaViewによって表示した結果のうち,有効性に関するものの一部である。Petoのオッズ比0.32,95%信頼区間(0.25〜0.41)で,プラセボ投与群と比較して1/3に有意に発症が抑えられている。
レビューの考察と結果 には,ヘルスケアの決断に関連するエビデンスの強さ,結果の適用性,コストと現在行われている診療との考察,介入によって予想される効果 ,害,コスト間のトレードオフなどが含まれる。読者が,これらの結果から,自分の患者がレビューされた母集団に合致するか,介入のエビデンスは十分か,効果 は害やコストを十分上回るものか,他の介入と比べて効果は十分かなどを総合的に判断して患者に適用するかどうかを検討するのである。
EBMにおいては,RCTによるエビデンスが最強のものとして分類されることが多い。しかし,コクラン共同計画のシステマティックレビューはその方法論からいって,単独のRCT以上にエビデンスが強力であることは,疑う余地もない。
- 津谷喜一郎:コクラン共同計画とシステマティック・レビュー.薬理と治療 25(1): 11-24, 1996
- Chalmers I, Altman DG: Systematic review, BMJ Publication Group, London, 1995 [津谷喜一郎,別府宏圀,浜六郎(監訳):システマティックレビュー,サイエンティスト社(近刊)]
- 名郷直樹:EBM実践ワークブック.南江堂, 1999
- 福井直仁:第1回コクラン・ハンドサーチ・ワークショップ・レポート.The Informed Prescriber 12(3): 26-27, 1997
- Mulrow CD,Oxman AD (ed) : Cochrane Collaboration Handbook [ver.3.0.2, updated September 1997] . In: The Cochrane Library [database on disk and CDROM]. The Cochrane Collaboration. Oxford: Update Software; 1997, Issue 4
- Shultz KF, Chalmers I et al: Empirical evidence of bias: dimensions of methodological quality associated with estimates of treatment effects in controlled trials. JAMA 273: 408- 412, 1995
- adad AR, Moore RA et al: Assessing the quality of reports of randomized clinical trials: Is blinding nesessary ?. Controlled Clinical Trials 17: 1-12, 1996
