
片山 私どもが習ったアルドステロンの知識は,遠位尿細管,集合管,大腸,唾液腺などの上皮組織でナトリウムの再吸収に働き, 高血圧と低カリウム血症をきたすといった程度でした。 1955 年に,原発性アルドステロン症の第 1 例が Conn により報告され,わが国でも東北大学で第 1 例が報告されました。 しかし,当時は測定が難しかったこともあり,そのたびに学会報告がされたものです。
武田 電解質調節作用を有するステロイドホルモンとしてアルドステロンが分離・同定されて今年で 53 年になります。 1955 年に Conn がアルドステロン産生腫瘍を原発性アルドステロン症として報告し,アルドステロンの臨床的重要性が確立されました。 1960 年代,アルドステロンの分泌調節に関わるレニン・アンジオテンシン系の存在が話題になり,鉱質コルチコイド受容体拮抗薬であるスピロノラクトンが開発され, 1970 年代に臨床応用されましたが,その後 20 年ぐらいはアルドステロン研究に関してあまり進歩がみられませんでした。 ところが 1990 年前後に遺伝子工学的手法を応用し,副腎領域でもステロイドホルモン合成酵素の遺伝子や,受容体遺伝子のクローニングがなされ, 先天性疾患の遺伝子解析が行われ,比較的知識が増加しました。
アルドステロンに関しても大きな進歩がみられ,1985 年に Hollenberg らが糖質コルチコイド受容体のクローニングを, 2年遅れて Arriza らが鉱質コルチコイド受容体のクローニングをしました。 in vitro で発現させますと,鉱質コルチコイド受容体にはアルドステロンも結合しますが,糖質コルチコイドであるコルチゾールにも同程度に結合する。 そうしますと,生体内ではどのようにして選択性が決められているのかが問題になります。 Funder らのグループは,生体内でアルドステロンが鉱質コルチコイド受容体選択的に結合する際, 11β−hydroxysteroid dehydrogenase という酵素が重要な役割を果たしていることを発見しました。 この酵素はコルチゾールをコルチゾンという不活化されたステロイドホルモンにすることにより,鉱質コルチコイド受容体に対するアルドステロンの選択性を決定しています(図 1)。
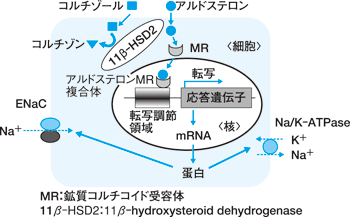
1990 年代には,この酵素の遺伝子異常がアパレント鉱質コルチコイド過剰症候群(syndrome of apparent mineralocorticoid excess:AME)の原因であることも明らかになりました。
武田 もう一つ大事なのは,腎臓を介することなく心臓や血管に直接アルドステロンが作用し, 心肥大や心線維化を起こすことが Weber らの動物実験で明らかにされたことです。 私たちもアルドステロンが直接血管平滑筋細胞の増殖を引き起こすことを報告しました。
1999 年には,重症の心不全患者にアンジオテンシン変換酵素(ACE)阻害薬,利尿薬,ジギタリス製剤に少量のスピロノラクトンを併用投与した群と投与しない群で生命予後をみた RALES(Randomized Aldactone Evaluation Study)大規模スタディの結果が出ました。 スピロノラクトンを投与した群では死亡率が 30%,心不全による再入院率が 35%改善したという驚くべき結果でした。 重症心不全の病態にアルドステロンが重要な働きをしていると解釈できるデータです。 このような基礎的・臨床的データから,アルドステロンが腎臓を介するナトリウム貯留による体液貯留および血圧の上昇以外に心血管系に作用して循環器疾患に影響を及ぼしていることが明らかになってきました。 さらに腎臓においても,アルドステロンが直接メサンギウム細胞などに作用し腎機能障害を引き起こすといったデータが,ここ 5 年間ぐらいで出てきています。
武田 従来アルドステロンの作用は,細胞質内に存在する鉱質コルチコイド受容体と結合し, そのホルモン受容体結合体が核内に移行し,転写から蛋白合成までの一連の反応が進むと理解されていました(図 1)。これがいわゆるゲノム作用です。
ところがアルドステロンを in vitro または in vivo で投与しますと,数分以内という非常に早い反応が起こる。 これは先に述べましたゲノムを介さない非ゲノム作用らしいということで注目されています。
従来,非ゲノム作用は鉱質コルチコイド受容体を介さないということで,鉱質コルチコイド受容体拮抗薬であるエプレレノンとかスピロノラクトンでは抑制されないといわれていました。 しかし,最近の研究ではエプレレノンなど新しいアルドステロン受容体拮抗薬で抑制されるような急性効果も報告されています。
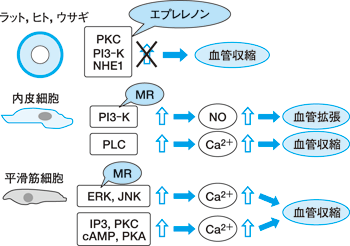
PKC や PI3−K,NHE1(Na/H exchanger 1)は介在するものですが,こういうものは血管収縮を起こすといわれています。 ところが血管内皮と平滑筋に分けて検討しますと,血管内皮では PI3−K を介して NO を増やし血管拡張を起こすようなアルドステロンの急性効果があります。 これは鉱質コルチコイド受容体を介する作用であることが報告されています。 一方,PLC を介して細胞内カルシウムを増やすような作用は血管収縮を起こす。これは鉱質コルチコイド受容体を介さない非ゲノム作用であるという報告があります。
平滑筋では一貫して血管収縮を起こすということで,ERK(extracellular signal−regulated kinase)と JNK(c−Jun N−terminal kinase)を介するようなものは鉱質コルチコイド受容体を介した作用,IP3, PKC,cAMP,PKA を介するものは受容体を介さない急性効果と報告されています(図 2)。 これら急性効果は循環器領域や腎臓関連の病態に関与していると考えられます。
武田 私の場合,アメリカ留学から帰ってきて間もない 1981 年,病棟に原因不明の心不全患者が入院しておりました。 大部屋で大いびきをかくので眠れないというクレームがあって,SAS が問題にされつつあった時期でもあり,調べてみたらそうでした。 当時はホルター心電図を用い,心拍数を経時的に調べました。 心拍数が周期的に少なくなったり多くなったりしたことから SAS を疑いました。 そのとき瀧島先生から,ホルター心電図と同じように外来で睡眠中の呼吸をモニタできるような装置を開発する必要があるのではないかという宿題をいただいた。 それがきっかけで携帯用睡眠モニタを開発しました。現在のアプノモニタです。このことが睡眠医療に関わるようになった契機です。
片山 それは先生方のお仕事ですが,アルドステロンが血管壁からつくられるのではないかと考えたきっかけは何だったのですか。
武田 当時は腸間膜動脈の灌流実験をしておりまして,ペプチドを含めていろいろなホルモンを測りました。 その中でステロイドホルモンも引っ掛かってこないかを調べました。 大量の灌流液を摘出し,高速液体クロマトグラフィで分離しアルドステロン様免疫物質を検出し GC/MS で同定しました。
当初は ex vivo の実験ですので,循環血中のコンタミネーションの可能性も考えられたので副腎全摘したラットを用いて検討したのですが, 血中にはアルドステロンは測定できず,灌流液中にはアルドステロンが検出できる。おそらく血管で産生されているのだろうと考えました。
片山 心臓などでも直接的な産生が証明され,今ではアルドステロンが心血管系の組織でつくられることは常識となってきていますね。